Luminescentie

Wat is luminescentie?
Onder luminescentie verstaan we alle lichtemissie waarbij geen warmte gepaard gaat. Een gloeilamp is bijvoorbeeld geen luminescentie, terwijl een glow-in-the-dark noodsein licht uitstuurt zonder warmte te creëren, dus wel luminescent is. Er zijn gigantisch veel applicaties waar men luminescente materialen vindt zonder het te weten. Bijvoorbeeld: beeldschermen, tl-lampen, LED's, noodseinen, ....
Welke vormen van luminescentie bestaan er?
Het onderscheid tussen de verschillende vormen luminescentie is onder verdeeld door de manier waarop een materiaal wordt geëxciteerd:
- Fotoluminescentie: Excitatie door licht zelf
- Elektroluminescentie: Excitatie door een elektrische stroom of aanleg van een sterk elektrisch veld
- Kathodeluminescentie: Excitatie door het invallen van een elektronenbundel
- Chemoluminescentie: Excitatie door chemische energie
- Bioluminescentie: Chemoluminescentie door levend organisme
- Radioluminescentie: Excitatie door blootstelling aan ioniserende straling
- Mechanoluminescnetie: Licht wordt uitgezonden bij druk of breken van ene materiaal

Mechanoluminescentie

Bioluminescentie
Fotoluminescentie is hetgeen wat bruikbaar is voor NIR beeldvorming. Dit zijn materialen waar we met licht kunnen exciteren en het licht dan weer opvangen.
Organische luminescente materialen worden vaak fosforen genoemd.
Eigenschappen van luminescente materialen
1. Excitatie spectrum
Het excitatie spectrum van een luminescent materiaal vertelt u met welke golflengtes het materiaal kan geëxciteerd worden. Excitatie is het fenomeen waarbij een foton geabsorbeerd en met die energie wordt een ander foton geëmitteerd.
2. Emissie spectrum
Wanneer de fosfor wordt geëxciteerd en dus energie heeft opgeslaan, wordt deze energie weer vrijgeven. Als deze energie wordt gebruikt voor het creëren van een foton verkrijgt men licht. Het spectrum dat hier uitkomt noemt men het emissie spectrum en geeft aan welke golflengtes we in het uitgezonden licht terugvinden. Het emissie spectrum ligt altijd lager in energie dan het excitatiespectrum. Dit is logisch aangezien men behoud van energie heeft en er deels energie verloren gaat in het materiaal in de vorm van warmte.
3. Efficiëntie
Dit geeft aan hoe goed het materiaal de inkomende energie kan omzetten naar uitgaande energie. Voor vele toepassingen wilt men zo hoog mogelijke lichtemissie. Door het materiaal aan te passen kan men dit zo hoog mogelijk proberen verkrijgen. Men heeft altijd verliezen, zoals productie van warmte, die we niet-radiatief verval noemen.
4. Vervaltijd
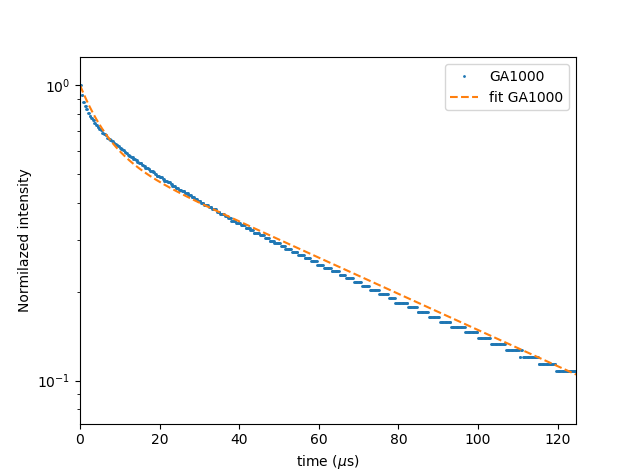
Het licht dat we zien zakt in intensiteit in verloop van de tijd. De waarde die men hier gebruikt komt van de vervalwet en wordt vervaltijd genoemd. Na 1 vervaltijd is de oorspronkelijke intensiteit teruggevallen op 1/e wat ongeveer 37% is. Deze vervaltijd kan variëren over verschillende grootteordes. Er zijn fosforen gekend met extreem korte vervaltijden van enkele nano en femto seconden en er zijn er gekend met zeer lange vervaltijden van enkele uren en zelfs dagen. Het is zelfs mogelijk om twee of meer verschillende vervaltijden tegelijk te hebben, zodanig dat er een snelle en een trage component aanwezig is.
Als men de intensiteit uitzet op een logaritmische schaal, verkrijgt men een rechte, zoals hieronder weergegeven. Deze bestaat uit twee vervaltijden, want we zien twee rechten.
Maak jouw eigen website met JouwWeb